| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 |
- 여행
- 대만
- 유기화학
- quantum chemistry
- 물리화학
- 화학
- travel
- Computational Chemistry
- 타이베이
- Chemistry
- Aromaticity
- 양자역학
- Gaussian
- 양자화학
- Physical Chemistry
- Organic Chemistry
- Today
- Total
Daily Project
[Organic Chemistry] 물리적 특성 (Physical Properties) 본문
[Organic Chemistry] 물리적 특성 (Physical Properties)
Jun_Hyeong 2019. 8. 15. 22:25유기화학 프로젝트의 세 번째 포스팅의 주제는 분자의 물리적인 성질(Physical Properties)들입니다.
대부분의 분들이 물의 끓는점(boiling point)은 100℃라는 사실을 알고 있을 거예요. 펜 테인의 끓는점은 36℃인데, 크기가 작은 물의 끓는점은 100℃나 될까요? 이러한 질문들의 해답을 알기 위해서 오늘은 분자의 물리적인 성질들을 Intermolecular Interaction을 통해서 분석해보는 시간을 가져봅시다!
1. Boiling Point

먼저 끓는점(Boiling Point)는 액체가 기체로 변환될 때의 온도를 의미합니다. 물질들이 서로 다른 끓는점을 가지는 이유는 무질서한 기체 상태로 되기 위해서 극복해야 할 분자 간의 인력이 다르기 때문입니다. 즉, 분자 간의 힘이 더 강력하다면 더 높은 끓는점을 가지고 있다고 할 수 있습니다.
이온 화합물의 경우 강력한 Ion-Ion interaction을 보여주기 때문에 매우 높은 끓는점을 가지고 있습니다. NaCl의 경우에는 끓는점이 무려 1413℃입니다. 그에 비해서 공유 화합물의 경우에는 더욱 낮은 끓는점을 보여줍니다. 공유 화합물의 끓는점을 비교하기 위해서는 분자의 작용기를 확인하는 것이 중요합니다.

먼저 분자량이 거의 비슷한 분자들인 pentane과 butanal, 1-butanol을 비교해봅시다. pentane의 경우에는 작용기를 가지고 있지 않지만, butanal과 1-butanol은 각각 카보닐기(carbonyl group)과 하이드록시기(hydroxy group)를 가지고 있습니다. 세 개의 분자들은 분자량과 표면적도 비슷하기 때문에 거의 유사한 van der Waals forces를 가질 것이라고 생각할 수 있지만 butanal과 1-butanol은 pentane과 달리 극성분자이기 때문에 dipole-dipole interaction을 가질 것입니다. 그렇기 때문에 두 개의 분자는 pentane에 비해서 intermolucular force가 강하다는 것을 알 수 있습니다.

그리고 1-butanol은 butanal과 다르게 hydrogen bonding을 할 수 있기 때문에 butanal보다 강력한 intermolucular force를 가진다는 사실도 알 수 있습니다. 그렇기 때문에 우리는 비슷한 분자량을 가지는 분자들의 끓는점을 비교할 때는 intermolucular force의 세기를 비교함으로써 차이점을 알 수 있습니다.

그렇다면 비슷한 작용기를 가지고 있는 화합물들의 경우는 어떨까요? 우리는 두 가지 측면에서 분석해볼 수 있습니다. 첫 번째는 표면적(Surface area)의 효과이며 두 번째는 분극률(polarizability)의 효과입니다.
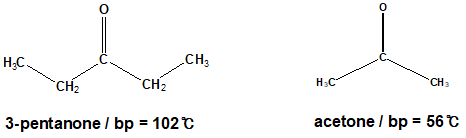
이번에는 3-pentanone과 acetone을 비교해봅시다. 3-pentanon과 acetone은 카보닐기(carbonyl)라는 같은 작용기를 가지고 있지만, 3-pentanone는 더 큰 표면적을 가지고 있다는 것을 알 수 있습니다. 그렇기 때문에 3-pentanone은 acetone에 비해서 강한 intermolecular forces를 가지며, 더 높은 끓는점을 가지고 있을 것이라는 것을 알 수 있습니다.
그렇다면 iodomethane과 fluoromethane는 어떨까요? 우리는 아이오딘이 플루오린에 비해서 더 높은 분극률을 가지고 있다는 사실을 알고 있기 때문에 iodomethane이 fluoromethane에 비해서 강한 intermolecular forces를 가지며, 더 높은 끓는점을 가지고 있을 것이라는 것을 알 수 있습니다!

2. Melting Point

끓는점이 액체에서 기체로 변환될 때의 온도라고 하면, 녹는점은 고체가 액체로 변환될때의 온도입니다. 끓는점과 유사하게 녹는점도 intermolecular forces가 큰 화합물이 더 높은 녹는점을 가집니다. 하지만 고체의 경우에는 기체나 액체에 비해서 더욱 정렬되어 있기 때문에 화합물의 대칭성을 고려해줘야 합니다.

비슷한 분자량과 같은 작용기를 가지는 화합물들에 대해서 더욱 compact 하고 대칭적인 모양을 가지는 화합물이 그렇지 않는 화합물보다 높은 녹는점을 가지게 됩니다. 그 이유는 neopentane과 같은 분자들은 compact하고 대칭적이기 때문에 결정격자에 packing이 잘 되는 반면, isopentane은 그렇지 않기 때문입니다.
3. Solubility

용해도(Solubility)는 용질(solute)이라 불리는 화합물이 용매(solvent)라 불리는 액체에 용해되는 정도입니다. 용해도의 경우에는 "Like dissolves like."라는 말로 표현할 수 있습니다. 즉, 극성 화합물은 극성 용매에 녹고 무극성 또는 약한 극성 화합물은 무극성 또는 약한 극성 용매에 녹는다는 말입니다.
그렇다면 왜 비슷한 친구들끼리 용해되려 하는 것일까요? 그 이유는 NaCl을 물에 녹이는 것과 hexane에 녹이는 것을 비교해보는 것을 통해서 알 수 있습니다. NaCl을 물에 용해시킬 경우에는 강력한 Ion-Ion interaction이 많고 약한 ion-dipole interaction으로 변환되면서 더 안정해지기 때문입니다. 하지만 hexane의 경우에는 ion-dipole interaction과 같은 방법으로 안정화될 수 없으므로 용해되지 않는 것입니다.

대부분의 유기 화합물들은 유기용매들에 잘 용해됩니다. 그렇다면 물의 경우에는 어떨까요? 유기 화합물이 물에 녹기 위해서는 hydrogen bonding을 필요로 합니다. acetone의 경우에는 분자들끼리 수소결합을 할 수는 없지만 물과는 수소결합이 가능하기 때문에 물에 용해될 수 있습니다. ethanol도 같은 맥락으로 물에 용해될 수 있습니다. 하지만 cholesterol과 같이 하이드록 시기가 있어서 수소결합을 할 수 있음에도 불구하고 탄소 골격(carbon backbone)이 너무 큰 경우에는 물에 용해될 수 없습니다.

우리는 분자에서 물과 수소결합을 할 수 없는 무극성 부분을 소수성(hydrophobic)이라고 말하며, 물과 수소결합을 할 수 있는 극성 부분을 친수성(hydrophilic)이라고 부릅니다. 콜레스테롤의 경우에는 하나의 하이드록시기가 친수성이며 나머지 큰 탄소 골격 부분은 소수성입니다.
Problem Session

만약 캅사이신을 섭취해서 매운맛을 줄이고 싶다면 물을 먹는 것과 우유를 먹는 것 중에서 무엇이 효과적일까요? 캅사이신의 분자구조와 물, 우유의 분자구조를 통해서 답을 내봅시다.
Answer
캅사이신에서 친수성 부분은 소수성의 부분에 비해서 매우 작기 때문에 물에 녹지 않을 것으로 예상할 수 있다. 그에 비해서 우유의 경우에는 소수성부분이 매우 크기때문에 캡사이신을 용해시킬수 있을 것으로 예상 할 수 있다. 그렇기 때문에 우유를 마시는 것이 효과적일 것이다!
'Chemistry Project > Organic Chemistry' 카테고리의 다른 글
| [Organic Chemistry] 공명 #1 (Resonance #1) (0) | 2020.06.22 |
|---|---|
| [Organic Chemistry] 형식 전하 (Formal Charge) (0) | 2020.06.22 |
| [Organic Chemistry] 작용기와 반응성 (Functional Groups and Reactivity) (0) | 2019.08.17 |
| [Organic Chemistry] 분자들 사이에 작용하는 힘 (Intermolecular Forces) (2) | 2019.08.15 |
| [Organic Chemistry] 작용기 (Functional Group) (1) | 2019.08.13 |




