| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 | 31 |
- 여행
- 유기화학
- 양자화학
- Gaussian
- 물리화학
- Physical Chemistry
- Organic Chemistry
- 양자역학
- 화학
- quantum chemistry
- Aromaticity
- 타이베이
- 대만
- Computational Chemistry
- travel
- Chemistry
- Today
- Total
Daily Project
[Physical Chemistry] 화학결합 : 이원자 분자 #2 (The Chemical Bond: Diatomic Molecules #2) 본문
[Physical Chemistry] 화학결합 : 이원자 분자 #2 (The Chemical Bond: Diatomic Molecules #2)
Jun_Hyeong 2020. 9. 24. 00:10
[KeyWords]
LCAO-MO(Linear Combination of Atomic Orbital-Molecular Orbital), SCF(Self-Consistent Field),
결합차수(Bond Order), 분자 항기호(Molecular Term Symbol)
#Molecular Orbital Theory: H2
수소 분자는 2개의 전자를 가지고 있으며 분자 파동 함수는 비대칭적이여야합니다. 바닥상태일 때 파울리 배타 원리에 의해 두 쌍의 스핀을 가지므로 스핀 부분은 비대칭적이고 공간 부분은 대칭적일 것 입니다. 헬륨 원자와 비슷하게 다음과 같은 Slater Determinant를 이용해 파동 함수를 만들어봅시다.

바닥상태에 대해서 결합 오비탈은 이전 포스팅의 Equation (23)1방법이라고 부릅니다.
#LCAO-MO Method
이전 포스팅 2, 반대의 경우에는 σu 3라고 부릅니다.
σ 오비탈은 다양한 방법으로 만들어 질수 있는데, 예를 들어서 σg2s의 경우 2개의 2s 원자 오비탈로 구성된 결합 분자 오비탈을 의미합니다. 그리고 σ 오비탈을 구성하는 원자 오비탈의 에너지가 높으면 높을수록 분자 오비탈의 에너지도 함께 높아집니다 [footnote] 마디(node)의 개수가 증가하기 때문 [/footnote].

- π orbitals
결합축에 수직 방향을 따라서 정렬된 원자 p-오비탈과 d-오비탈은 π 오비탈을 형성합니다. σ 오비탈과 비슷하게 πg와 πg를 형성하지만 p-오비탈을 2등분하는 마디면(nodal plane)때문에 결합 오비탈(πu)이 ungarade 대칭을 가지며 반결합 오비탈(πg)이 garade 대칭을 가집니다.
- SCF-LCAO-MO
간단한 LCAO-MO 방법은 원자 오비탈의 곱을 통해서 분자 파동 함수를 생성합니다. 이러한 분자 오비탈은 합리적인 형태와 화학 결합의 물리적 의미을 제공하지만 충분히 정확한 에너지 값과 결합 길이를 제공해주지 못하는 단점을 가지고 있습니다. 그래서 더 많은 원자 오비탈을 포함한 시행 함수를 사용하고 하트리-폭 방법을 사용한 바닥상태 파동 함수를 사용함으로써 LCAO-MO 방법을 발전시킬 수 있습니다. 이를 통해서 얻어진 분자 오비탈은 SCF-LCAO-MO 4라고 부릅니다.
그러나 우리는 실제 시스템의 분자 오비탈은 원자 오비탈로 구성되지 않는다는 것을 알아야합니다. 전자는 단지 핵과 다른 전자로부터 포텐셜을 느끼고 그 즉시 에너지적으로 최적화된 분포를 찾습니다. 즉, 분자 속에 원자 오비탈은 존재하지 않는다는 것 입니다. 단지 분자 오비탈을 쉽게 만들기 위해서 원자 오비탈을 사용하는 것 입니다. 그러므로 SCF-LCAO-MO는 아래의 표처럼 명명법에 원자 오비탈이 포함되어 있지 않습니다.
| Simple LCAO-MO | SCF-LCAO-MO |
| σg/u1s | 1σg/u |
| σg/u2s | 2σg/u |
| πg/u2px/y | 1πg/u |
| σg/u2pz | 3σg/u |
- Relative Energies : Pauli exclusion principle and Hund's rules
Figure 1은 동핵 이원자 분자(homonuclear diatomic molecule)인 Li2에서 F2까지의 분자 오비탈의 에너지를 나타냅니다. 이전 포스팅에서 알아보았듯이, 분자 오비탈은 파울리 배타 원리와 훈트의 법칙에 따라 전자가 점유합니다. 이를 통해서 우리는 산소가 상자기성을 보여주는 이유를 알 수 있습니다.

또한, Figure 1에서 원자 번호가 증가함에 따라서 분자 오비탈의 상대적인 에너지가 낮아지는 것을 확인 할 수 있습니다. 이는 원자번호가 증가할 수록 핵의 전하가 증가하기 때문입니다. 특히, σ 오비탈의 경우 σg2pz 오비탈이 πu보다 에너지가 낮아질 정도로 큰 영향을 받습니다.
- Bond order
화학결합의 강도를 표현하기 위해서 소위 결합 차수(bond order)을 다음과 같이 정의합니다.

예를들어 질소(N2)의 결합 차수는 3입니다. H2+의 경우 결합 차수는 1/2로 결합 차수는 반정수(half-integer)가 될 수 있습니다.
#Molecular Term Symbol

원자의 전자 상태를 원자 항기호(atomic term symbol)로 나타낸것 처럼 분자의 전자 상태도 분자 항기호(molecular term symbol)로 나타낼 수 있습니다. 우리는 다음과 같은 과정을 통해 B2 분자의 분자 항기호를 결정할 것 입니다.
- STEP 1 : Calculate the possible ML and MS values

B2의 바닥상태 전자 배치는 다음과 같습니다.
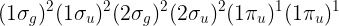
첫번째 4개의 분자 오비탈은 완전하게 점유되어 있기 때문에 ML과 MS는 0입니다. 부분적으로 차있는 껍질, (1πu)1(1πu)1의 경우 πu의 ml은 ±1이기 때문에 가능한 ML은 ±2와 0가 될 것 입니다. 그러므로 우리는 항기호를 표현할 때 L 대신에 |ML|을 사용 할 것입니다. 그리고 MS의 경우 가능한 값은 ±1와 0입니다.

- STEP 2 : Find all possible configurations corresponding to the ML and MS values using the Pauli exclusion principle
| MS | |||
| ML | 1 | 0 | -1 |
| 2 | 1+,1- | ||
| 0 | 1+,-1+ | 1+,-1- ; 1-,-1+ | 1-,-1- |
| -2 | -1+,-1- | ||
- STEP 3 : Find the all |ML| values and their corresponding S values
위의 표에서 가운데 줄은 |MS|=0에 해당하므로 이에 해당하는 S 값은 1이 될 것 입니다. 이것의 항기호는 Equation (10)과 같이 표현됩니다.

그리고 대문자 알파벳 대신 아래의 표처럼 대문자 그리스 문자가 사용됩니다.
| |ML| | Letter |
| 0 | Σ |
| 1 | Π |
| 2 | Δ |
| 3 | Φ |
그러므로 0Δ와 0Σ이 가능할 것입니다.
- STEP 4 : Determine the ground state term symbol using the Hund's rules
가장 큰 S를 가진 상태가 바닥상태이므로 B2의 바닥상태의 항기호는 3Σ입니다.
- STEP 5 : Determine additional symmetries of the term symbol or the molecuar electronic wave function
항기호에 해당하는 분자 파동 함수는 분자 오비탈의 곱이므로 다음과 같이 파동 함수의 기본 대칭을 결정할 수 있습니다.
(1) gerade or ungarade
Equation (8)에서 우리는 부분적으로 점유된 분자 오비탈만을 고려했습니다. B2의 경우 (1πu)1(1πu)1가 이에 해당합니다. 2개의 분자 오비탈은 모두 ungarade이기 때문에 두 기함수(odd function)의 곱으로 표현되는 파동 함수는 우함수(even function)가 되어야 합니다. 그러므로 바닥상태의 항기호는 3Σg입니다.
(2) reflection
만약 y-z 평면에 대해서 분자 오비탈의 부호나 위상이 바뀐다면, 분자오비탈은 반사에 대해서 - 대칭을 가지고 있습니다. 반대의 경우 + 대칭을 가집니다. 1πu는 πu2px와 πu2py로 분리 될 수 있고, 그들은 각각 - 대칭과 + 대칭을 가지고 있습니다. 그러므로 이들의 곱으로 표현되는 함수는 - 대칭을 가져야만 합니다. 즉, 바닥상태의 항기호는 3Σ-g입니다.
#Excited Electronic States
수소 원자처럼 분자도 들뜬 상태를 가질 수 있습니다. 예를 들어 수소 원자에 대해 알아봅시다.
바닥상태 : (1σg)2 ⇒ 1Σg+
첫번째 들뜬 상태 : (1σg)1(1σu)1 ⇒ 3Σu+ 와 1Σu+

Figure 2는 들뜬 상태의 핵간 포텐셜 에너지를 보여줍니다. 이때, 비록 훈트의 법칙에 의해 3Σu+가 더 낮은 에너지를 가져야 하지만, Figure 2를 통해 3Σu+ 반발적(repulsive)이라는 것을 알 수 있습니다. 그러므로 수소 분자의 들뜬 상태가 3Σu+가된다면
바로 해리될 것 입니다. 또한, 이론적으로 계산된 1Σu+상태의 평형 거리가 실험적으로 검증된 바닥 상태의 평형 거리 보다 깁니다. 즉, 수소 분자의 첫번째 들뜬 상태의 항기호는 1Σu+입니다.
- 관련 포스팅 : d2illy.tistory.com/44 [\footnote]으로 표현되기 때문에, 바닥상태 분자 파동 함수의 공간 부분은 Equation (2)와 같을 것 입니다.

Equation (2) 그리고 Equation (2)로 표현된 분자 파동 함수에 대응하는 에너지는

Equation (3) 그러므로 평형 거리(Equilibrium distance, Req)에서 결합 에너지(binding energy)는 0.0990Eh가 될 것 입니다. 그러나 실험적으로 얻어진 결합 에너지는 0.174Eh로 예측한 값과 큰 차이가 있는 것을 확인 할 수 있습니다. 그러므로 시행 함수에 더 많은 기저 함수(basis function)를 포함시켜 정확도를 향상시킬필요가 있습니다.
이때, 원자 오비탈의 선형 결합을 통해 분자 파동 함수를 구성하는 방법은 LCAO-MO [footnote] LCAO : Linear Combination of Atomic Orbital [본문으로]
- 관련 포스팅 : https://d2illy.tistory.com/44 [/footnote]에서 LCAO-MO 방법을 통해서 수소 분자 이온의 분자 오비탈을 구성했습니다. 이처럼 LCAO-MO 방법은 결합 오비탈을 생성할 뿐만 아니라 반결합 오비탈도 생성합니다. 다음과 같은 방법으로 LCAO-MO 방법으로 만들어진 분자 오비탈을 명명할 것입니다.
- σ orbitals
원자 오비탈의 돌출부(lobe)가 결합축을 따라 결합되면 LCAO-MO를 σ 오비탈이라 부릅니다. 이에 해당하는 반결합 오비탈은 σ* 오비탈이라 부릅니다. 더 일반적으로 분자 오비탈이 반전 대칭(inversion symmetry)를 가지고 있으면 σg [footnote] g는 독일어로 짝수를 뜻하는 gerade를 의미 [본문으로]
- u는 독일어로 짝수를 뜻하는 ungerade를 의미 [본문으로]
- Self-Consistent Field Linear Combination of Atomic Orbital [본문으로]
'Chemistry Project > Physical Chemistry' 카테고리의 다른 글
| [Physical Chemistry] 다원자 분자의 결합 (Bonding in Polyatomic Molecules) (1) | 2020.09.25 |
|---|---|
| [Physical Chemistry] 화학결합 : 이원자 분자 #1 (The Chemical Bond: Diatomic Molecules #1) (1) | 2020.07.22 |
| [Physical Chemistry] 다전자 원자 #4 (Multielectron Atoms #4) (0) | 2020.07.21 |
| [Physical Chemistry] 다전자 원자 #3 (Multielectron Atoms #3) (0) | 2020.07.20 |
| [Physical Chemistry] 다전자 원자 #2 (Multielectron Atoms #2) (1) | 2020.07.19 |




